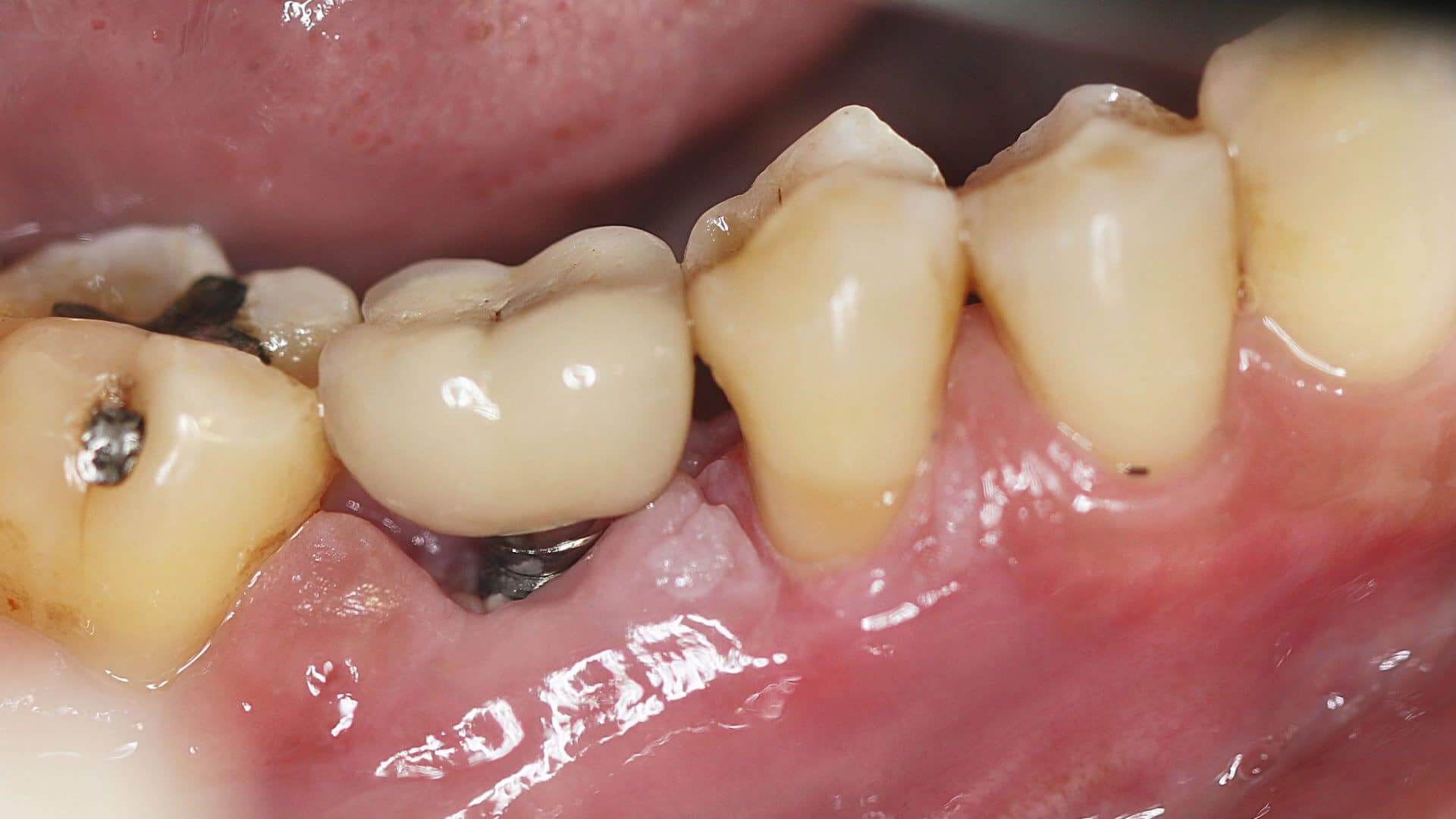
Rund 80 Prozent aller niedergelassenen Zahnärzte setzen jährlich circa 1,3 Millionen Implantate in Deutschland. Im Vergleich dazu: In den USA sind es gerade mal 100.000, mit steigender Tendenz. 1956 entdeckte man, dass Titanium mit dem Knochen, in den es eingebracht wird, verschmelzen kann. Damit war die Grundlage für moderne Implantate geschaffen. Seit den 70er-Jahren ist die Implantologie auf dem Vormarsch, seit 1982 ist sie auch wissenschaftlich anerkannt. Hauptgründe für den steigenden Einsatz von Implantaten sind der demografische Wandel und die Bereitschaft der Patienten, sich auch teure Versorgungen zu leisten, um dadurch eine bessere Lebensqualität zu haben. Häufig können durch Implantatlösungen herausnehmbare Versorgungen vermieden werden, da erst ein Implantat eine festsitzende Lösung ermöglicht. Nun ist es aber mit dem Setzen des Implantats allein nicht getan, um diese Erwartungen auch dauerhaft zu erfüllen. Die richtige häusliche Implantatpflege ist das A und O.
Ein Implantat ist anfälliger für Entzündungen!
Vielen Patienten ist nicht klar, dass ein künstliches Implantat empfänglicher für Entzündungen ist als die eigenen Zähne. Eine intensive häusliche Zahn- und Implantatpflege mit adäquaten Hilfsmitteln bis hin zur richtigen Zahnpasta ist insbesondere bei Risikopatienten essenziell. Genau da muss auch das Praxisteam ansetzen, damit erfolgreich gesetzte Implantate auch dauerhaft zur gewünschten Verbesserung der Lebensqualität bei den Patienten beitragen: Es sollte Patienten in der häuslichen Prophylaxe anleiten und sie dazu motivieren, selbst zu Hause akribisch mitzuarbeiten.
Keime, Gene und äußere Umstände als Ursache
Mukositis und Periimplantitis sind multifaktorielle Entzündungen, die bei Implantaten in verschiedenen Verläufen auftreten. Entscheidend ist immer die inflammatorische Immunantwort des Patienten: Wie reagiert dessen Immunsystem auf die Entzündung? So ist es klinisch möglich, dass trotz hoher Entzündungswerte das Umfeld des Implantats nur wenig Entzündungsreaktion zeigt und auch umgekehrt, sich trotz niedriger Werte bereits starke Entzündungsreaktionen zeigen. Klinische Merkmale sind ein Bleeding on Probing (POB), ein Ansteigen der Taschentiefen (TT) und Rezessionen der marginalen Gingiva in Verbindung mit einem röntgenologisch nachweisbaren Knochenrückgang. Im Vergleich zum gesunden Parodont weisen periimplantäre Gewebe keinen Zement und kein parodontales Ligament auf. Das periimplantäre Gewebe ist oft länger, und in der Bindegewebszone sind keine Fasern, die in die Implantatoberfläche einstrahlen. Die Zone zwischen dem Knochenkamm und dem Saumepithel ist im Vergleich zum Bindegewebe des Parodonts weniger vaskularisiert und damit auch weniger durchblutet, sodass die Körperabwehr auf pathogene Keime auch verzögert abläuft und damit Entzündungen begünstigt1. Neben der genetischen Disposition, den exogenen Faktoren und der Immunantwort spielen parodontopathogene Keime in signifikant erhöhter Konzentration ebenfalls eine große Rolle. Insbesondere anaerobe Keime begünstigen durch die Besiedelung der Biofilme und Erzeugung zytotoxischer Substanzen, die zu destruktiven Zellabbauprozessen besonders im periimplantären Bereich führen, das Entstehen einer Periimplantitis.
Praxistipp für die Implantatpflege
Biofilme geben den die Periimplantitis auslösenden Keimen den Nährboden. Die effektive Entfernung dieser Biofilme ist daher das entscheidende Momentum. Das A und O für die häusliche Prophylaxe kann also lauten: Biofilme entfernen und somit den Nährboden entziehen und antibakterielle Inhaltsstoffe bei der Reinigung einsetzen, um jenen Keimen, die trotz akribischer Reinigung im Bereich des Implantats verbleiben, effektiv zu begegnen. Untersuchungen an der Universität Jena2 haben ergeben, dass durch die mechanische Reinigung mit Ajona die bakterielle und mykotische Keimbesiedelung der Biofilme nachweislich stark reduziert werden kann. Durch den Zusatz zahlreicher ätherischer Öle werden selektiv nur die Bakterienwände, nicht aber die körpereigenen Zellwände zum Platzen gebracht werden. Diese Wirkung hält sogar noch bis zu zwölf Stunden an. Da die Öle wirkaktiv an Ort und Stelle verbleiben, werden diese kritischen Bereiche bis zur nächsten Reinigung optimal geschützt. Je nach Zusatz ätherischer Öle reagieren moderat bis stark zum Beispiel folgende pathogenen Keime: Prevotella intermedia, Fusobacterium nucleatum, Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis und Laktobazillen (L. casei, L. corniformis und L. plantarum).
Wirksam gegen Streptokokken
Auch einige Streptokokken (S. sanguinis, S. sorinus und S. mutans) werden zusätzlich stark in ihrem Wachstum gehemmt. Dies ist sehr wichtig, da auch S. mutans nicht nur bei der Entstehung von Karies, sondern auch bei der Entstehung einer Periimplantitis eine bedeutende Rolle einnimmt. Besonders Patienten mit einem erhöhten Papillenblutungsindex (PBI) kann die Verwendung von Ajona zur häuslichen Pflege von Implantaten empfohlen werden. Weitere Effekte sind, dass die Rekolonisation mit Bakterien auf den Biofilmen ebenfalls verzögert wird. Zwei Mal pro Tag eine kleine Menge, aufgetragen auf eine Interdentalraumbürste, reinigt effizient schwer zugängliche Stellen gründlich mit einer langanhaltenden antibakteriellen Wirkung. Quelle: 1 Berglundh T, et al., J Clin Periodontol 2018; 45 (Suppl 20): s. 286291 2 Studien zum antimikrobiellen Effekt von verschiedenen Zahnpasten, Universitätsklinikum Jena, 2010 bis 2012.